发布时间:2024-08-28 13:06:45
因缺乏血管和神经,自然修复能力有限,关节软骨损伤的治疗一直是个挑战。自自体软骨细胞植入(ACI)首次报道以来,细胞疗法已被广泛研究,涉及多种细胞来源,包括自体软骨细胞和间充质干细胞/基质细胞(MSCs)。MSCs因来源广泛、采集容易,以及具有自我更新和多向分化的潜能,受到了研究界广泛的关注。利用MSCs,研究者通过简单的细胞培养方法,开发了一种三维无支架组织工程结构(TEC),并在首次人体临床试验中证实了其修复和再生软骨的可行性[1]。
简介
关节软骨损伤在矫形外科领域治疗的患者人群中很常见。在一项1000例膝关节镜检查的前瞻性研究中,19%的患者存在局灶性软骨或骨软骨缺损。在这些患者中,61%的患者当前的膝关节问题与先前的创伤有关,并同时伴有半月板或前交叉韧带损伤,分别占42%和26%。
关节软骨因缺乏血管和神经,以及在发育和成熟过程中形成相对独特的基质组织,受损后通常不会自发愈合。关节软骨一旦受损,由于软骨病变无法有效愈合,可发展为骨关节炎(OA)。对于OA患者来说,他们通常不得不减少体力活动,并调整生活方式。据统计,个人平均每年因OA产生的费用估计在700到15600美元之间。因此,在过去几十年中,临床学家已经尝试了各种方法来改善软骨的愈合以及预防OA的进展。
自1994年Brittberg等人首次发表ACI的结果以来,细胞疗法已被广泛研究,涉及多种细胞来源,包括自体软骨细胞和MSCs。基于自体软骨细胞的治疗虽然在临床应用中取得了积极成果,但存在一定的局限性,如对正常软骨的损伤、细胞体外扩增的潜在改变以及老年患者中细胞的可用性限制。相比之下,基于MSCs的治疗已经成为促进组织修复再生的焦点。MSCs可以从多种组织中分离出来,如骨髓、骨骼肌、滑膜、脂肪组织和脐带血以及滑膜液。从滑膜中分离的MSCs可能较适用于软骨修复,因为它们获取相对容易,并且具有很强的软骨分化能力。
在选择最佳细胞来源的同时,如何有效地将细胞递送至软骨损伤处是成功进行细胞治疗的另一个重要问题。目前,种植有细胞的三维(3D)支架是一种被广泛采用的增强缺损修复的方法。然而,这些支架通常是由合成聚合物和/或生物材料制造,因而存在长期安全性和有效性问题。因此,在治疗过程中应排除使用这些材料,以减少未知风险。无支架细胞递送系统将是一个极好的替代品。
基于此,研究人员开发了一种新型的无支架的3D组织工程结构(TEC),它由滑膜来源的MSCs和细胞外基质(ECM)组成,并证实了它们用于软骨修复的可行性。这种新的、无支架的、基于MSCs的技术作为下一代软骨修复载体已经引起了人们的关注。
TEC的体外培养
在基础生长培养基中贴壁培养时,滑膜来源的MSCs并不能合成丰富的胶原基质。相比之下,添加>0.1 mM抗坏血酸-2磷酸(Asc-2P)后,随着培养时间的延长,滑膜MSCs胶原合成显著增加。随后,细胞-基质复合物变成由MSCs和细胞合成的ECM组成的坚硬片状结构(图1A)。通过温和的机械分离,片状结构主动挛缩形成较厚的3D组织(图1B),称为TEC。免疫组化分析显示,TEC富含I型和III型胶原,而不表达II型胶原蛋白。当把TEC置于软骨培养基中培养,糖胺聚糖(GAG)和II型胶原合成增加。这些TEC还富含纤连蛋白和玻连蛋白等粘附分子。研究发现,这些TEC具有柔韧性,且可高度粘附于软骨,因此,无需缝合就可以植入到受损的软骨表面。
图1 TEC大体观察
TEC在猪软骨缺损模型中的研究
由于小动物的关节软骨厚度有限,很难在不破坏软骨下骨的情况下制造软骨损伤。考虑到临床相关性,最好利用大型动物模型来研究骨骼成熟度对细胞修复软骨病变疗法的影响。为了评估TEC在体内模型中的有效性,研究者选择了猪模型,因为猪的生理机能在许多方面与人类相似,而且猪的膝关节软骨足够厚,可以在不损伤软骨下骨的情况下形成软骨缺损。
在进行体内研究之前,研究者首先证实了骨骼未成熟及成熟动物MSCs的体外增殖和软骨形成能力均无显著差异。为了验证TEC在较广受体年龄范围内修复软骨损伤的可行性,使用了未成熟和成熟的猪软骨损伤模型。在猪股骨内侧髁上制造直径8.5 mm且不破坏软骨下骨的全层软骨缺损,然后将TEC植入未成熟猪和成熟猪的缺损软骨中。植入后,TEC无需缝合即可牢固附着于损伤关节面。植入后6个月,无论是未成熟还是成熟的动物,对照组均没有显示出任何自我修复的迹象,或者只有少量的组织覆盖;而TEC治疗组缺损则被软骨修复组织覆盖。组织学结果显示,对照组中软骨缺损均表现出OA的典型变化,包括软骨的丧失和软骨下骨的破坏(图2A和B);相反,当使用TEC治疗时,缺损被修复组织填充,这些修复组织与邻近软骨良好融合,软骨表面平滑(图2C和D)。此外,高倍视野显示,无论动物成熟度如何,TEC治疗后的修复组织都表现出透明软骨样的组织特征,番红O染色呈阳性(图2C和D)。无论受体猪的年龄如何,植入的TEC均未显示中心性坏死或免疫排斥反应(异常炎性巨噬细胞和淋巴细胞反应)。值得注意的是,在植入体内后,TEC由最初富含I型胶原转变为富含II型胶原,表明TEC受到植入部位环境的显著影响。无论植入时的年龄如何,受损软骨在TEC治疗6个月后的生物力学性能均类似正常软骨。
图2番红O染色:对照组软骨病变(A, B)及TEC处理组软骨病变(C, D)
TEC首次在人体临床试验中修复膝关节软骨病变
本研究纳入5例软骨缺损患者(软骨缺损1.5~3.0cm2;4男1女;年龄28~46岁),全身麻醉,膝关节采集滑膜(>1g),对其进行MSCs的分离培养及扩增,传代至第一或第二代。4~6周后收获TEC,待植入(图3A)。行小关节切开术,清除软骨病变,避免破坏软骨下骨(图3B)。植入前,无菌PBS多次清洗TEC,尽量减少血清相关蛋白的污染,调整TEC的大小以匹配软骨缺损。5~10分钟内完成TEC植入,无需任何加固固定(图3C)。膝关节固定2周后,进行活动范围练习和肌肉训练。植入手术6~8周后可完全负重,12个月后可恢复剧烈活动。该临床研究的主要终点是安全性,次要终点为有效性。通过自我评估确定患者对手术的满意度,手术两年后通过MRI评估修复组织的形态质量,并于48周时对修复组织进行宏观和组织学分析。在2年的观察期内没有记录到不良事件。术后2年,患者在疼痛、症状、日常生活活动、运动活动和生活质量方面的自我评估,临床评分均有显著改善。所有病例均通过第二次关节镜检查(图4A)和MRI检查证实缺损填充安全。活检标本的组织学显示修复组织类似透明软骨的组成和结构(图4B)。因此,这些结果为自体滑膜来源MSCs的无支架TEC促进软骨修复的安全性和有效性提供了证据。通过简单快速的植入过程,TEC疗法可以提供一种高软骨生成、低医疗费用、高患者满意度的新型治疗选择。
图3 TEC的植入
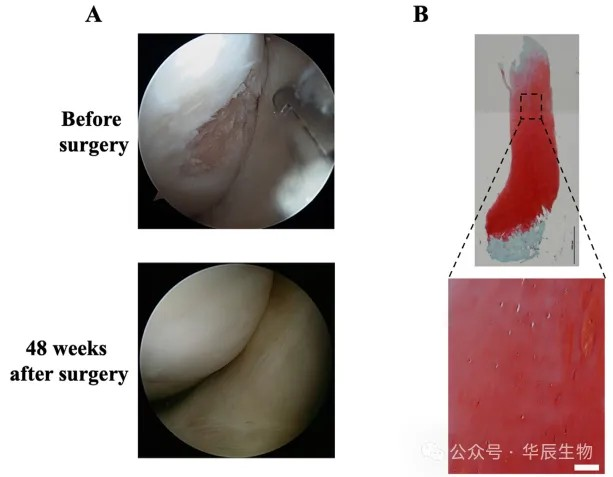
图4 TEC植入后48周的关节镜和活检标本的组织学检查
TEC植入修复膝关节软骨病变的中期结果
我们进一步评估植入后5年的临床和MRI结果,以评价TEC治疗的持续有效性。所有临床评分,包括疼痛的视觉模拟量表Lysholm评分、Tegner评分和膝关节损伤与骨关节炎结果评分(KOOS),从术前评估到2年和5年随访,均得到显著改善,且随着时间的推移结果较稳定(图5)。MRI扫描评估显示软骨缺损被新生的组织填充,并且这些新生成的组织与邻近宿主组织融合良好(图6)。修复软骨的厚度和表面光滑度在术后维持长达5年。磁共振观察软骨修复组织(MOCART)2.0膝关节评分在5年时仍保持较高水平。因此,这些结果证实了TEC无需缝合、通过简单的植入手术修复软骨的有效性和可行性, 显示出良好的临床结果和MRI表现,且中期随访结果稳定。
图5 5年随访,患者报告的结果:KOOS亚量表(A)症状,(B)疼痛,(C)ADL,(D)运动与娱乐,(E)QOL。
图6损伤软骨部位(黄色箭头)的MRI定位质子密度加权像扫描
未来的展望和结论
本研究综合了过去几年获得的研究结果,证实了使用滑膜MSCs生产无支架TEC进行软骨修复的可行性。此外,一项纳入更多患者的III期多中心随机对照临床试验已经完成,截至2024年4月,结果正在进行分析(JRCT ID: jRCT1080223548, TWOCELLS, Co., Ltd.)。这项试验的结果将进一步界定这种基于MSCs的治疗相比另一种现有治疗方案(微骨折法)的重要性。
TEC进行软骨修复有几个优点。与其他软骨组织工程方法相比,TEC是由自体滑膜MSCs生产的,不需要任何外源性支架,降低了与支架相关的潜在的副作用。此外,TEC是一种柔软的球形体,对软骨基质具有可塑性和黏附性,它们能够匹配缺损的形状与大小,修复软骨缺损,并适用于微创手术的快速无缝合植入。因此,TEC方法可以提供一种新的具有高成软骨能力、高安全性和较低成本的治疗选择。
TEC也可以从其他组织来源的MSCs中开发,例如脂肪组织,可在不进入关节的情况下轻松获得,从而避免与切除滑膜相关的任何潜在疾病的发生。因此,未来使用TEC技术的组织工程可能为再生医学提供多种治疗干预措施。使用不同来源的MSCs进行多种组织应用,以满足个体所患多种肌肉骨骼损伤的修复和再生需求。
参考文献
Kazunori Shimomura, Wataru Ando, David A. Hart, et al., A novel scaffold-free mesenchymal stem cell-derived tissue engineered construct for articular cartilage restoration - From basic to
clinic. Regenerative Therapy 26 (2024) 124-131.
返回顶部