发布时间:2024-08-28 13:55:14
近期,苏州华辰生物科技有限公司(下文称“华辰生物”)的间充质干细胞无血清培养基产品已成功获得美国FDA下属生物制品评价与研究中心(Center of Biologics Evaluation and Research, CBER)的药物主文件DMF(Drug Master File)备案,备案号为DMF 039951。
这标志着应用相关产品的客户,在提交干细胞治疗产品的IND申报项目时可直接引用,有利于缩短沟通,审查和评估时间,从而加速相关药品的申报进程。
间充质干细胞无血清细胞培养基通过DMF备案是华辰生物团队在干细胞培养领域深耕多年的重要成果,这意味着华辰生物的生产工艺和品质控制体系已经达到了国际标准和监管要求,其产品质量可靠、安全性高。
什么是DMF?
DMF文件是持有者递交给FDA的药物存档文件,包含在生产、操作、包装和储存过程中使用到的厂房,操作流程或使用的物质的保密细节信息,为制药企业、药物生产商和监管机构提供了优化的解决方案。药物生产商仅需向FDA递交DMF文件,由FDA来进行审核并且对此文件保密,从而避免技术机密的泄露。同时,药品上市申请者可以直接使用DMF备案编号来代替申报过程中需要提供的相关具体信息,从而节约在申报过程中的时间和沟通成本,加快药物的监管审评进程。
为什么要进行DMF备案?
实行 DMF 可节约审评资料,减少重复申报,加速制剂生产企业对原辅料的审计。制剂生产商向 FDA 提交注册申请资料时,直接以 DMF 归档号来代替制剂申请资料中有关辅料、包材的具体资料,既简化了制剂申请的内容,又减少了原料企业因向众多制剂客户提供资料而造成企业技术机密外泄的风险。
华辰生物自主开发的间充质干细胞无血清培养基系列产品已完成美国 FDA DMF 备案,这意味着,如果您的干细胞药物研究项目正在或计划进行临床申请或新药注册,在取得华辰生物的官方授权信(无需支付授权费用)后,您即可在监管所需的备案文件中直接引用我们的 DMF 编号,从而节约产品审查和评估时间,缩减新药临床申报的准备工作。
关于novastem-MSC
间充质干细胞无血清培养基
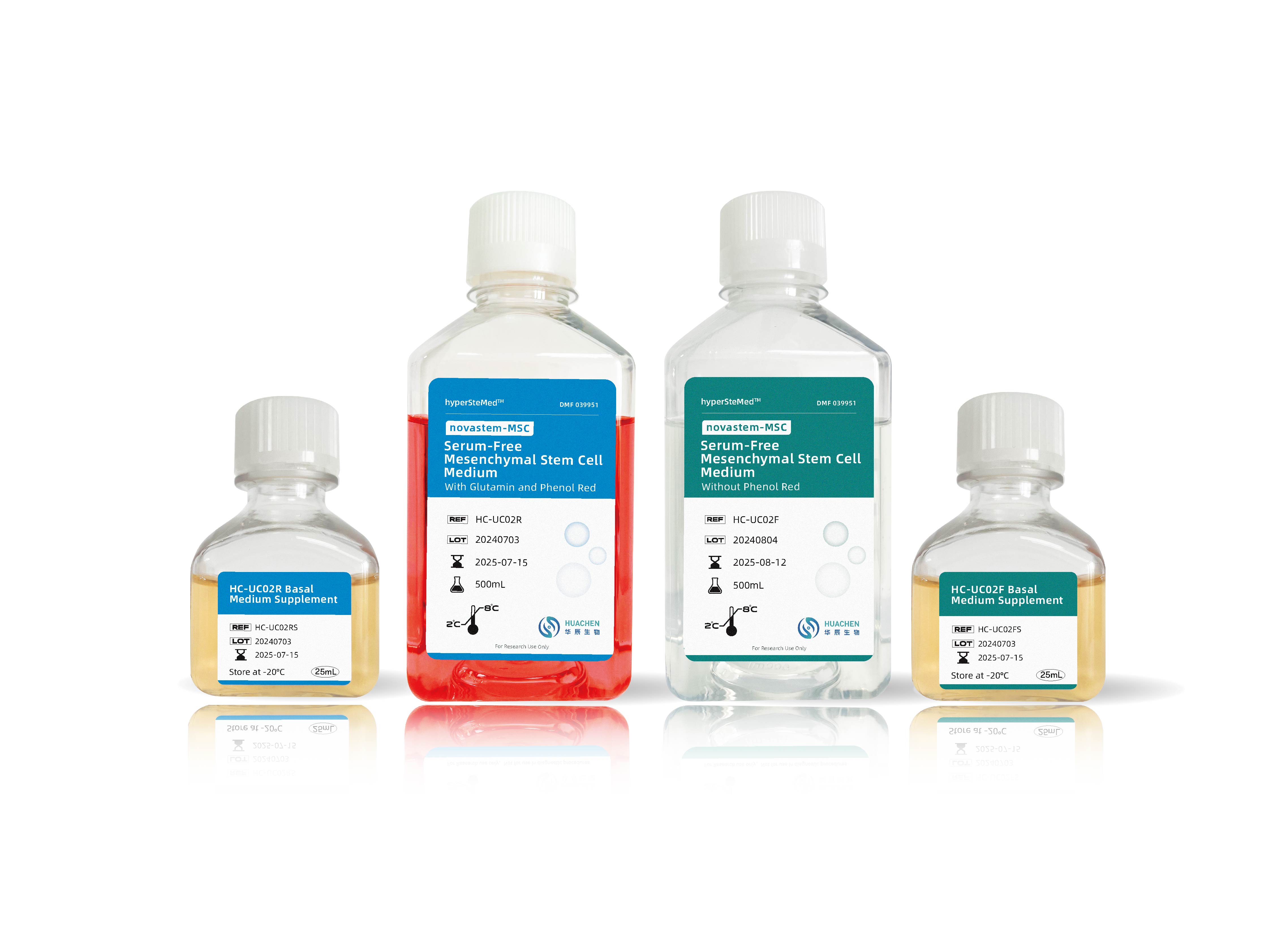
特点优势:
● 适用于间充质干细胞原代分离和传代培养;
● 兼容多种间充质干细胞:脐带、脂肪、骨髓等;
● 无血清,无任何动物源组分,不含抗生素,性能稳定,批间差小;
● 高细胞扩增率,单个代次扩增倍数达20倍以上;
● 单个T175培养瓶细胞收获>2E7;
● 细胞直径14μm左右,小于市场同类型产品,临床更安全有效;
● GMP level,注射用水配制;
● 自主化研发与生产体系,供货稳定,性价比高。
原代培养
传代培养
novastem-MSC 培养基传代扩增倍数
返回顶部